|
|
|
|
|
香港, 2022年2月16日 - (亞太商訊) - 中國抗體製藥有限公司(「中國抗體」或「公司」,連同其附屬公司,統稱「集團」;股份代號:3681.HK),專注研究、發展、製造及商業化免疫性疾病療法的香港生物製藥公司,欣然宣佈於二零二二年二月十一日(美國東部當地時間),公司已就用於哮喘的第一類(First-in-Class)治療產品 SM17(注射用人源化抗 IL-17RB 單克隆抗體)提交新藥研究申請(「IND」),有關申請已獲美國食品藥品監督管理局 (U.S. Food and Drug Administration,「FDA」)受理。公司計劃一旦新藥研究申請獲 FDA 批准,最早於二零二二年第一季度在美國啟動首次人體臨床研究。
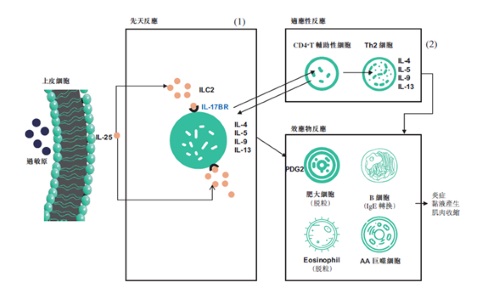 | | SM17的作用機制 |
SM17,是中國抗體與劍橋大學合作、全球首創針對IL17BR靶點的單抗藥物,所覆蓋的適應症較為多元,既能針對哮喘這類市場體量巨大的適應症,也能治療特發性肺纖維化這類致死率高的疾病,相較於已知的其他在售藥物,在源頭上已具備差異化優勢。SM17的臨床前數據和獨特的作用機制使我們相信SM17可能比其他獲批准的生物製劑對哮喘治療有更廣泛和更有利的作用。
在全球市場上,哮喘患者的數量正在逐漸增加,預計在二零二三年將達到2.475億,並在二零三零年進一步增加到2.677億。而中國的哮喘患者數量的增長速度高於全球增長率,預計在二零二三年將達到2,560萬,並在二零三零年進一步增加到2,780萬。從市場規模上,預期全球哮喘產品市場於二零二三年前將達到251億美元,於二零三零年前將達到 346億美元。而中國哮喘產品市場將預期於二零二三年前將達到人民幣364億元,於二零三零年前將達到人民幣650億元。從治療方案上,傳統哮喘治療以吸入皮質類固醇為主,但易產生嚴重的不良反應,特別是對青少年。長期使用還會產生耐藥性。SM17的推出,有望在有效性和安全性的平衡上提供更佳的治療方案。
中國抗體主席、執行董事兼首席執行官梁瑞安博士表示:「繼公司早前公佈SN1011新藥研究申請(針對多發性硬化症)獲中國國家藥品監督管理局藥品審評中心受理後,本次SM17新藥研究申請獲FDA受理,充分反映公司推展新藥研發項目的高效執行力。目前嚴重哮喘的有效治療仍存在未滿足的醫療需求,尤其是對當前療法無應答的患者而言,我們對 SM17 巨大的臨床開發前景充滿信心。公司多款核心產品,包括SM03、SN1011及SM17的臨床研發順利推進,意味著公司正穩步向實現商業化目標前進。未來我們將加快推進項目,通過產品創新,為患者謀求福祉、為股東創造價值。」
關於SM17
SM17是已知全球首創用於新藥開發, 針對IL-17BR靶點的人源化IgG4-κ單克隆抗體。IL-17RB屬於IL-17受體家族的一種I型單跨膜糖蛋白。SM17 結合IL-17RB 後,可抑制由一類被稱為「警戒素」的細胞因子導致的 Th2 細胞相關免疫反應,而「警戒素」已被證明與過敏性疾病的病理過程及氣道細胞的病毒感染反應有關。作為哮喘治療的新路徑,靶向 Th2 炎性細胞因數通路上游介質(例如「警戒素」)的療法,預計將對氣道炎症相關的病理變化產生更廣譜的作用,從而較現有療法更為有效地控制哮喘症狀。目前已有針對「警戒素」相關信號通路,與 SM17 具有相若作用機制的嚴重哮喘療法獲FDA批准。
關於中國抗體製藥有限公司
中國抗體製藥有限公司專注於研究、發展、製造及商業化免疫性疾病療法。公司注重科技研發,其旗艦產品SM03為全球首項用以治療類風濕關節炎的潛在抗CD22單抗,已在中國進入類風濕關節炎三期臨床試驗,並被列為國家十三五重大新藥創制專項重大項目。此外還有多個同類靶點首創(First-in-target)及同類首創(First-in-class)在研藥物,部分已處於臨床階段,適應症覆蓋類風濕性關節炎、系統性紅斑狼瘡、尋常型天皰瘡、非霍奇金氏淋巴瘤、哮喘等具有重大未滿足臨床需求的疾病。
話題 Press release summary
部門 制药及生物技术, 健康与医药
http://www.acnnewswire.com
From the Asia Corporate News Network
Copyright © 2026 ACN Newswire. All rights reserved. A division of Asia Corporate News Network
|
|
|

|
|
|
 |
| SinoMab BioScience Limited |
 |
| Apr 9, 2025, 14:41 HKT/SGT |
| 中國抗體製藥有限公司SM17治療特應性皮炎1b期概念驗證臨床試驗取得突破性結果 |
 |
| Apr 16, 2024, 17:44 HKT/SGT |
| 中國抗體SM17治療特應性皮炎(AD)之臨床前結果刊登於國際科學期刊《Allergy》 |
 |
| Sept 12, 2023, 09:49 HKT/SGT |
| 中國抗體SM17新藥研究申請再獲國家藥監局批准 |
 |
| Aug 14, 2023, 21:11 HKT/SGT |
| 中國抗體SM17針對治療哮喘疾病的新藥研究申請獲國家藥監局批准 |
 |
| June 12, 2023, 20:44 HKT/SGT |
| 中國抗體SM17再增一項適應症研究申請 針對治療特應性皮炎(AD)的新藥研究申請獲國家藥監局藥品審評中心受理 |
 |
| May 22, 2023, 10:21 HKT/SGT |
| 中國抗體SM17針對治療哮喘的新藥研究申請獲國家藥監局藥品審評中心受理 |
 |
| Dec 19, 2022, 14:56 HKT/SGT |
| 中國抗體榮獲「第七屆金港股」評選中「最具價值醫藥及醫療公司」獎項 |
 |
| Nov 4, 2022, 17:48 HKT/SGT |
| 中國抗體宣佈委任王善春先生為中國區總裁 |
 |
| Oct 18, 2022, 13:29 HKT/SGT |
| 訪中國抗體製藥創辦人梁瑞安:現是香港發展創科最好時候 |
 |
| Aug 24, 2022, 08:06 HKT/SGT |
| 中國抗體宣佈SN1011針對視神經脊髓炎譜系疾病的新藥研究申請獲國家藥監局批准 |
 |
| July 8, 2022, 19:00 HKT/SGT |
| 中國抗體獲香港科學園最高專項補貼 |
 |
| June 21, 2022, 15:39 HKT/SGT |
| 中國抗體的旗艦產品舒西利單抗SM03的作用機理在美國免疫領域權威期刊the Journal of Immunology上成功發表 |
 |
| June 15, 2022, 13:04 HKT/SGT |
| 中國抗體在美國完成SM17 I期臨床試驗首例健康受試者給藥 |
 |
| June 9, 2022, 12:49 HKT/SGT |
| 中國抗體公佈SN1011新藥研究申請獲中國國家藥品監督管理局藥品審評中心受理 |
 |
| Apr 20, 2022, 19:34 HKT/SGT |
| 中國抗體公佈SN1011新藥研究申請獲國家藥監局批准 |
 |
| Mar 14, 2022, 20:33 HKT/SGT |
| 中國抗體用於哮喘的第一類治療產品SM17新藥研究申請獲FDA批准 |
 |
| Feb 7, 2022, 18:06 HKT/SGT |
| 中國抗體公佈SN1011新藥研究申請獲中國國家藥品監督管理局藥品審評中心受理 |
 |
| Jan 11, 2022, 16:56 HKT/SGT |
| 中國抗體榮獲「第六屆金港股」評選中「最佳中小市值公司」、「最佳CEO」獎項及「2021新浪財經金麒麟最佳港美股上市公司」評選中「最具成長潛力上市公司」獎項 |
 |
| Nov 30, 2021, 20:51 HKT/SGT |
| 中國抗體公佈旗艦產品SM03完成在中國III期臨床試驗招募 |
 |
| Nov 25, 2021, 18:27 HKT/SGT |
| 中國抗體受邀出席首屆亞洲醫療健康高峰論壇 |
 |
| 更多新闻 >> |
 |
|
|